2022年11月15日,我院徐平龙实验室在Molecular Cell上在线发表了题为“AMPK directly phosphorylates TBK1 to integrate glucose sensing into innate immunity”的工作。该研究首次报道了病毒感染极早期机体血糖水平急促下降并因此导致糖脂代谢核心分子AMPK显著激活的生理现象,鉴定了天然免疫关键激酶TBK1是AMPK的直接底物,并揭示了机体通过AMPK-TBK1信号轴双重感知核酸和葡萄糖分子水平的精巧机制。
核酸天然免疫识别(Innate nucleic acids sensing, INAS)是机体感知微生物入侵以及自身组织损伤的重要途径,对宿主细胞抵抗外源微生物感染和维持自身稳态至关重要。葡萄糖是生物体维持正常生命活动的主要能量来源,也是机体细胞感知环境变动的重要媒介。近年研究也发现高血糖症以及糖尿病与微生物感染,包括冠状病毒感染的易感性密切相关。但机体如何整合葡萄糖水平的信息并因此调控宿主免疫,目前还知之甚少。
蛋白激酶AMPK是机体主要的能量和葡萄糖丰度感应器,通过识别并修饰特定的氨基酸序列模式,磷酸化多种底物分子,并因此调控机体的糖类、脂类等代谢过程,维持细胞能量、氧化水平和营养平衡。我们起初在啮齿类动物病毒模型中发现一个有趣现象,不同类型的病毒感染都能诱导多种啮齿动物体内血糖水平迅速而急剧的下降,并因此导致组织和器官中AMPK的显著激活。随后的研究证明,AMPK能够直接识别TBK1蛋白的经典底物基序并高效磷酸化其511位丝氨酸,并因此促进TBK1的激活、TBK1-IRF3互作,以及MAVS和STING信号复合体的组装,从而显著促进天然免疫应答和抗病毒宿主防御。因此,降低葡萄糖水平、激活AMPK或者模拟AMPK修饰的TBK1基因定点敲入小鼠和细胞表现出超敏的天然免疫应答,而抑制或者阻断AMPK-TBK1信号则导致机体丧失对病毒感染的天然免疫识别和应答。
该工作发现了机体通过受控的血糖水平调控感染免疫的功能,揭示了TBK1是AMPK的直接底物,提出了机体危险信号-能量信号的双重感应机制。这些新发现展示了机体糖脂代谢与天然免疫应答的内在分子联系,是免疫代谢(immunometabolism)领域研究的重要拓展,也为靶向AMPK控制免疫应答提供了理论与实验依据。
徐平龙实验室张倩博士、刘盛铎博士和厦门大学张宸松教授为论文共同第一作者,徐平龙教授为通讯作者。研究工作得到了林圣彩教授、冯新华教授、梁廷波教授、黄耀伟教授等合作者的大力支持。研究受科技部重点研发计划、国家杰青基金、国自然重点项目、国自然面上项目等资助,在浙江大学开展并完成。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S1097276522010541
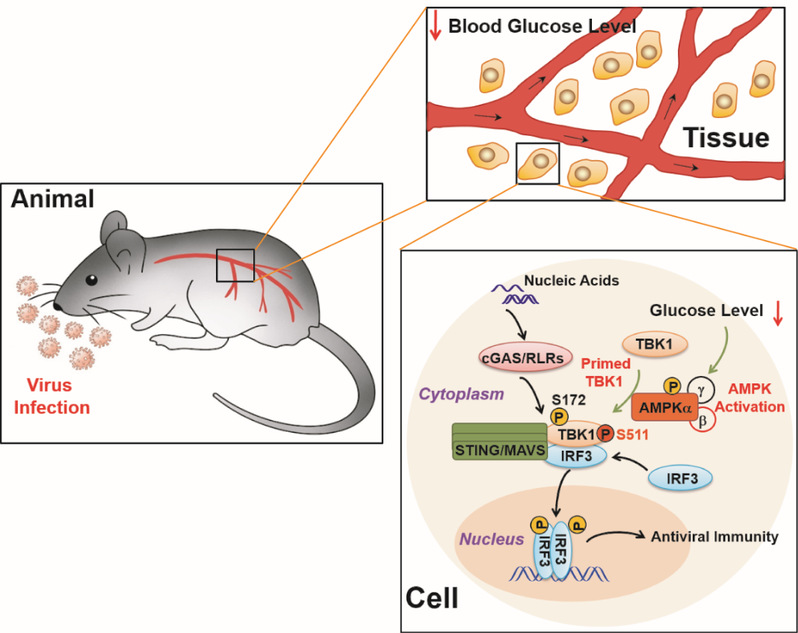
机体血糖水平通过AMPK-TBK1信号机制调控核酸识别与感染免疫应答
博士后、研究员招聘
徐平龙实验室运用跨学科研究技术体系,长期从事天然免疫识别的信号机制、调控及生理病理功能研究,在核酸免疫识别的细胞和病理功能、新型信号机制及调控机制等方向有系统性贡献,研究工作发表于Nature Cell Biology (2022, 2019, 2017)、Molecular Cell (2022, 2021, 2020, 2014)、Cell Host & Microbe、Genes & Development等知名学术期刊,并获国家杰青等多项基金资助。因研究拓展需要,诚聘代谢、神经、病理、感染免疫、细胞工程、生物材料、病毒、生物信息、药学等领域博士后(或者研究员)2-3名。岗位要求:对科学探索有浓厚兴趣和创新思维,有较强的独立科研工作能力和英文写作能力,富有团队合作精神。实验室提供优良的工作环境、科研平台和竞争性薪酬。有意向者请将个人简历和1-2篇已发表的代表作发送至pinglong_xu@163.com。




