由SARS-CoV-2病毒引发的新冠肺炎(COVID-19)仍在全球范围大流行。虽然已经有不同类型的疫苗及单克隆抗体(简称“单抗”)上市,但是新冠受关注突变体(Variants of Concern, VOCs)可通过疫苗突破(Vaccine breakthrough)及抗体逃逸等方式感染个体[1]。因此,筛选针对新冠VOCs的广谱(Broadly neutralizing)或全谱(Pan-neutralizing)单抗,不仅可以用于VOCs感染的预防及治疗,并对新冠通用疫苗(Universal vaccine)的研发具有重要的指导意义。
2021年12月01日,浙江大学朱永群团队,联合中山大学邓凯团队、陆军军医大学叶丽林团队在bioRxiv预印版发表了题为“A human monoclonal antibody potently pan-neutralizes SARS-CoV-2 VOCs by targeting RBD invariant sites”的论文,报道了一个高效中和新冠VOCs的全谱人源单克隆抗体,并解析了其独特的作用机制。

研究者前期研究表明,新冠康复病人的疾病程度与中和抗体水平呈正相关[2](https://mp.weixin.qq.com/s/AxCfcw7dujaYiCHeuhvdYg),因此可以推测,在新冠重症病人里,相对快速恢复者的体内可能具有更强的中和抗体。研究者从这一类康复病人里克隆到35B5单抗,并且该抗体可高效地中和一系列VOCs毒株,包括B.1.351(南非株;贝塔株)及B.1.617.2(印度株;德尔塔株)(图1)。
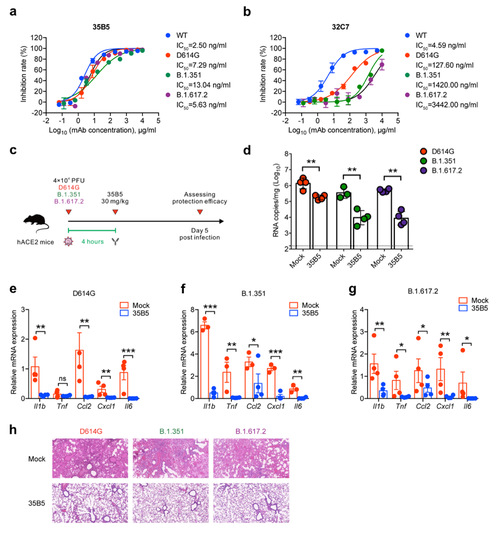
(图1、35B5高效中和新冠VOCs)
为了研究35B5抗体的广谱、强效中和作用的结构基础,研究者采用冷冻电镜技术尝试解析了35B5的Fab区与新冠病毒Spike蛋白的复合物结构。研究者发现,35B5 Fab在体外导致Spike蛋白S-2P稳定突变体的快速解聚,即使更加稳定的S-6P突变体也很容易被35B5 Fab解聚。通过快速冷冻的方法,研究者成功获得了35B5 Fab与S-6P突变体蛋白的复合物冷冻电镜样品,并解析了该复合物三个状态的结构。状态1复合物中Spike的3个RBD结构域中的2个处于典型up构象,并各结合一个Fab,而另一个RBD处于down构象;状态2复合物中的3个RBD均处于典型up构象,并各结合一个Fab;状态3复合物中的3个RBD也均有Fab结合,但只有1个处于up构象,其他2个处于往外摆出的释放(releasing)构象,暗示该Spike分子正在发生解聚(图2a)。进一步的结构分析提示,35B5 Fab可以通过识别down状态下 RBD的少数暴露的抗原表位氨基酸残基,通过与临近NTD结构域之间产生互斥力,导致RBD由down构象转变为up构象,引起Spike蛋白不稳定,RBD进而外摆进入releasing构象,从而解聚Spike三聚体结构(图2b)。
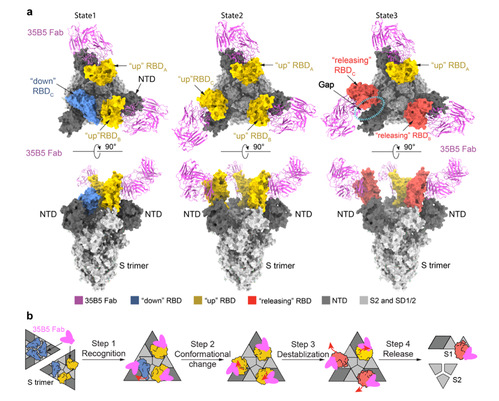
(图2、35B5 Fab区与新冠病毒Spike蛋白的复合物结构)
值得注意的是,35B5 Fab结合的RBD抗原表位面积高达1029平方埃,包含多达30个氨基酸残基(图3a)。这些氨基酸残基与35B5之间形成大量氢键和盐键,使得35B5对RBD的亲和能力可达pmol水平。此外,35B5识别的RBD抗原表位非常独特,与以往报道的四种RBD抗体的抗原表位都不一样,其位于I类抗体抗原表位(ACE2的结合区)的对面,说明35B5不直接阻断Spike对宿主受体的识别,虽与II类和III类抗体的抗原表位有部分重叠,但其大多数参与结合35B5的氨基酸残基均不在2类或3类抗体的抗原表位上(图3b)。
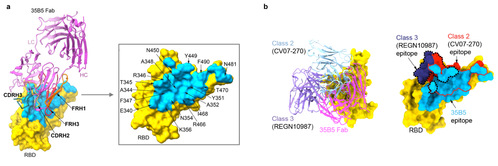
(图3、35B5单抗的结合表位结构解析)
目前流行的新冠病毒变异株在RBD上含有不同的突变[3-5],比如可增强病毒与受体结合能力的N501Y,可稳定Spike蛋白的L452R,导致多个抗体失效并协助免疫逃逸的K417N和E484K等。有趣的是,目前所发现的变异株突变位点均不在35B5与RBD的结合面上(图4a, b),包括B.1.351(南非株;贝塔株)及B.1.617.2(印度株;德尔塔株),这也解释了为什么35B5单抗对上述VOCs具有高效中和力。此外,最近发现的B.1.1.529株(omicron变异株)在RBD上有多处位突变,然而这些突变也不在35B5的结合面上图(图4c),提示了35B5抗体极有可能中和omicron变异株。因此,35B5的独特抗原表位为其广谱中和VOCs的特性提供了结构基础。
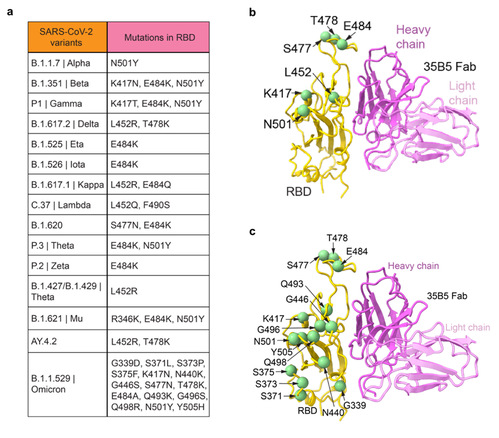
(图4、35B5单抗的结合表位与VOCs突变位点的关系)
该项工作表明35B5抗体具有较大的潜力,可用于新冠VOCs的预防及治疗;而被35B5抗体识别的表位,可能成为新冠广谱疫苗的重要抗原靶标。在这项工作里,博士生陈香宇克隆了35B5抗体,博士后王小飞解析了相关结构,博士后胡奥、博士生张译心和博士后余霏完成了新冠病毒的体外及体内中和实验。
原文链接:https://www.biorxiv.org/content/10.1101/2021.11.29.470356v1
参考文献
1.Corti, D., et al., Tackling COVID-19 with neutralizing monoclonal antibodies. Cell.
2.Chen, X., et al., Disease severity dictates SARS-CoV-2-specific neutralizing antibody responses in COVID-19. Signal Transduct Target Ther, 2020. 5(1): p. 180.
3.Yuan, M., et al., Structural and functional ramifications of antigenic drift in recent SARS-CoV-2 variants. Science, 2021.
4.Wang, P., et al., Antibody resistance of SARS-CoV-2 variants B.1.351 and B.1.1.7. Nature, 2021. 593(7857): p. 130-135.
5.Chen, R.E., et al., Resistance of SARS-CoV-2 variants to neutralization by monoclonal and serum-derived polyclonal antibodies. Nat Med, 2021.




