2017年6月14日,Cell Host & Microbe以长文(article)形式发表了徐平龙实验室题为“Lck/Hck/Fgr-mediated tyrosine phosphorylation negatively regulates TBK1 to restrain innate antiviral responses”的研究论文,报道抗病毒天然免疫关键激酶TBK1的新修饰模式与调控机制,该调控在整体动物中的生理功能,以及酪氨酸激酶小分子抑制剂在抗病毒防治中的重要应用前景。
细胞质核酸识别及其启动的抗病毒天然免疫存在于我们机体几乎所有类型的细胞中,是一类古老而进化上高度保守的细胞生物学机制,不仅对病毒感染防御至关重要,更在自身免疫疾病、神经退行性疾病及肿瘤发生中有重要功能。位于细胞质中的RNA/DNA模式识别受体,比如RIG-I或cGAS,能够侦测到病毒或自身泄漏的核酸并激活,通过线粒体或内质网定位的接头蛋白MAVS或STING,逐次活化关键激酶TBK1和转录因子IRF3,并激活NF-κB通路,诱导表达I/III型干扰素、干扰素诱导基因、促炎症细胞因子等一系列抗病毒因子,从而建立自身和周边细胞的抗病毒状态。抗病毒天然机制研究有重要的科学认知价值和应用前景,也是当前国际生物医学发展的主要前沿之一。蛋白酪氨酸磷酸化修饰,尽管只占到所有蛋白磷酸化修饰的2.5%,但在细胞的几乎所有生理进程中都有关键调控功能。抗病毒天然免疫通路的激活,传统上认识是由蛋白泛素化和蛋白丝苏氨酸磷酸化所介导,对于蛋白酪氨酸磷酸化修饰的作用与生理功能,未有深入探索和认知。
徐平龙实验室发现病毒感染过程中,在多种器官来源的细胞中都观察到细胞内源TBK1有动态的酪氨酸磷酸化修饰,并与TBK1激活与抑制紧密相关。随后通过小分子抑制剂和蛋白激酶文库筛选以及基因表达和CRISPR介导的基因敲除分析,确定Src家族酪氨酸激酶(SFKs)Lck、Hck、Fgr是导致静态和病毒感染过程中TBK1酪氨酸磷酸化修饰和功能抑制的主要激酶。分子机制上,发现Lck/Hck/Fgr与TBK1/IKKe相互作用并形成内源复合体,直接酪氨酸磷酸化修饰TBK1。Lck/Hck/Fgr主要修饰TBK1的394位和354位酪氨酸,破坏其形成TBK1同聚二体或TBK1/IKKe异聚二体的分子介面,导致TBK1失活。Lck/Hck同时也强烈修饰TBK1催化中心附近的153位酪氨酸,进一步阻抑TBK1激活。因此,Lck/Hck/Fgr的基因敲除或者药学抑制能显著提高细胞核酸识别通路的激活和抗病毒免疫应答,以及对RNA病毒和DNA病毒的抵抗能力。更为重要的是,Lck/Hck/Fgr的小分子抑制剂能显著增强小鼠与斑马鱼对病毒感染的防御,而Lck表达则明显削弱斑马鱼的病毒抗性。非常有意思的是,核酸识别通路的激活能直接通过IRF3介导的转录,强烈诱导Lck/Hck/Fgr蛋白表达,构成了对核酸识别通路的负反馈调控。研究因此鉴定了抗病毒应答关键激酶TBK1的直接酪氨酸磷酸化修饰以及修饰激酶,提出了酪氨酸磷酸化修饰和酪氨酸激酶在抗病毒天然免疫中的关键调控作用和生理功能,并深入解析了其抑制抗病毒应答和负反馈调控的分子机制。研究也首次指出了酪氨酸激酶抑制在抗病毒防治中的潜在重要价值。这些新发现为理解抗病毒免疫机制和发展抗病毒的防治手段提供了新的理论与实验依据。
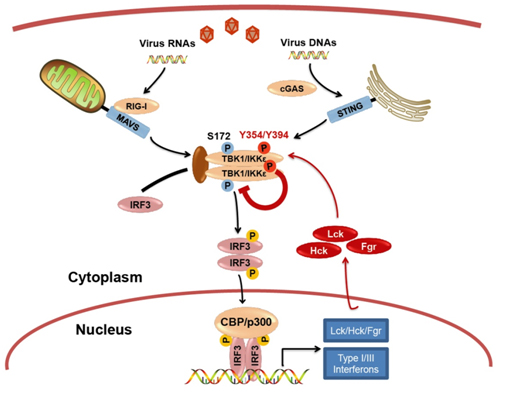
图:揭示TBK1络氨酸磷酸化抑制抗病毒天然免疫应答的功能与分子机制
徐平龙实验室2014级博士生刘盛铎和2014级硕士生陈莎莎为论文共同第一作者,李欣然博士、吴世英同学和张倩同学也在工作中有重要贡献,通讯作者为徐平龙教授。研究工作也得到了浙江大学冯新华教授、邹键教授、夏总平教授、叶升教授、沈立教授等大力支持。该研究受到国家自然科学基金、科技部973计划等资助,在浙大生研院开展并完成。
原文链接:http://www.sciencedirect.com/science/article/pii/S1931312817302032




