2018年10月3日,我院范衡宇教授实验室在Cell Death & Differentiation杂志报道了一个在进化过程中高度保守的核仁蛋白DCAF13在卵子发生(oogenesis)过程中的重要作用。
卵子是动物体内最大的细胞,肩负着向子代传递遗传物质和提供早期胚胎发育所需营养物质的双重使命。它的前体细胞――卵母细胞(oocyte),在个体发育的很早期就与体细胞走上了不同的分化道路。所有雌性哺乳动物(包括人类)出生之时,卵母细胞以原始卵泡的形式储存在卵巢中,供一生中所有的生殖活动所需。如果原始卵泡的储备不能维持,或者卵泡不能正常发育,就会造成卵巢早衰、雌性不育。范衡宇实验室过去几年中的系统研究表明,CRL4泛素连接酶复合体介导的生化过程,对于原始卵泡的维持、卵泡生长、卵子成熟和受精卵发育启动,都具有重要生理功能。CRL4通过DCAF家族蛋白作为底物识别亚基,去泛素化修饰多种靶蛋白分子。哺乳动物基因组中有大约90多种基因,负责编码具有DCAF家族结构特征的蛋白。但是目前对这些基因的生理功能研究还很少,也不清楚其中哪些DCAF在卵子发生过程中介导了CRL4的生理功能。
范衡宇研究团队首先利用了线虫这种更为简单的模式生物,系统研究了这一科学问题,因为可以通过给线虫饲喂表达siRNA的大肠杆菌来方便地实现特定mRNA的敲减。同哺乳动物中一样,敲减CRL4复合体的核心亚基如CUL4、DDB1导致线虫卵子发生的严重障碍。这种进化过程中的保守性进一步说明了CRL4在卵子发生中的具有不可替代的功能。在线虫基因组共有19个编码DCAF蛋白的基因,并且它们的对应基因在哺乳动物中都是保守的。课题组对所有线虫Dcaf基因进行了RNAi筛选,结果发现一个从前研究很少的基因zk430.7(对应于哺乳动物的Dcaf13基因),是线虫卵子发生所必需的(图1)。
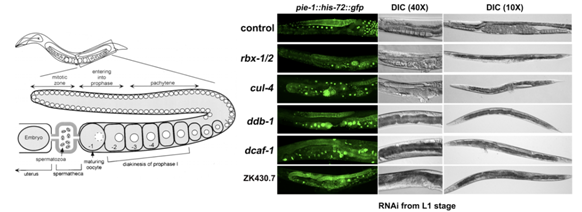
图1:线虫的卵子发生示意图,以及RNAi敲降CRL4泛素连接酶关键亚基导致的线虫卵子发生障碍。
然后,课题组的研究重点回归小鼠模型,证明DCAF13蛋白确实也在原始卵泡期和生长卵泡期的小鼠卵母细胞中表达,而且发现DCAF13是一个核仁蛋白(图2)。课题组为了研究Dcaf13基因的体内功能,制作了Dcaf13敲除小鼠,结果发现该基因缺失的胚胎在植入前就发生死亡(Zhang et al, EMBO Journal 2018),无法用于研究Dcaf13在卵子发生中的功能。于是,研究团队继续制作了卵母细胞特异性的Dcaf13敲除小鼠,并观察到缺失Dcaf13的卵母细胞生长缓慢,很快凋亡,造成卵巢早衰和雌性不育,证明DCAF13是一个从线虫到小鼠都保守的、对于卵子发生至关重要的CRL4底物识别蛋白。

图2:小鼠DACF13在卵巢中的表达和功能研究。A:免疫组化结果显示DCAF13在小鼠卵母细胞核仁中表达。B:卵母细胞特异性Dcaf13基因敲除造成卵巢早衰。
接下来,课题组从DCAF13定位于核仁这一线索入手,研究了DCAF13调控卵子发生的生化机制。DCAF13通过其C末端的SOF1结构域结合核糖体RNA前体(pre-rRNA),并且和其他重要核糖体蛋白如fibrillarin、NOP56相互作用,参与pre-rRNA的剪切和核糖体小亚基的组装。如果敲除Dcaf13,生长中的卵母细胞就不能积累足够的rRNA和核糖体,从而使细胞中整体蛋白合成水平下降,不能维持正常的卵母细胞功能和染色质构象转换,更不能建立起进一步发育成熟并排卵、受精的潜能(图3)。在体外培养的卵泡中敲减另一个核仁功能蛋白Fibrillarin也观察到与Dcaf13敲除有类似的表型,进一步说明它们具有功能上的联系。

图3:DCAF13在哺乳动物卵子发生过程中的功能示意图。A: DCAF13介导的核仁功能对于卵子发生过程中的rRNA储备和蛋白翻译非常重要。缺失Dcaf13基因的卵母细胞不具有进一步发育的潜能,造成卵母细胞凋亡、卵泡闭锁。B: DCAF13参与调控rRNA前体的剪切和核糖体小亚基的组装。
该研究的创新性在于:1)Dcaf13基因虽然在进化上高度保守,从酵母到哺乳动物都存在于基因组中,但这是首次研究其体内生理功能;2)DCAF13是目前发现的唯一一个主要在核仁中定位、并且参与调控rRNA转录后加工的CRL4底物识别蛋白;3)虽然多年前就观察到两栖动物卵母细胞的剧烈生长伴随着rDNA扩增、形成灯刷染色体,并写入多种细胞生物学、发育生物学教科书,但其实这一现象并不存在于哺乳动物中。本研究第一次报道了核仁功能调控蛋白参与维持哺乳动物原始卵泡存活和卵母细胞生长,为卵巢早衰、卵子老化等女性生殖障碍提供了新的潜在机制。




